반응형
Arrhenius equation (아레니우스 식)
속도 상수의 온도 의존성을 수식으로 나타낸 식
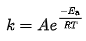
- k = rate constant (frequency of collisions resulting in a reaction)
- T = absolute temperature (in Kelvin)
- A = pre-exponential factor
(arrhenius originally considered A to be a temperature-independent constant for each chemical reations. However, more recent treatments include some tmperature dependence)
- Ea = activation energy for the reaction
- R = universal gas constant, 8.314 J K-1 mol-1
Ea (activation energy)의 결정
Arrehnius 식의 양변에 자연대수 ln을 취하면 아래와 같고,
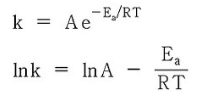
이 식을 일차방정식 꼴로 정리하면, 아래와 같다.
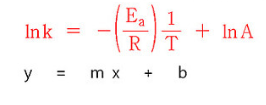
이로부터 활성화 에너지는 기울기(m)로 부터 구할 수 있다. (y 절편을 이용하면 A도 구할 수 있음)
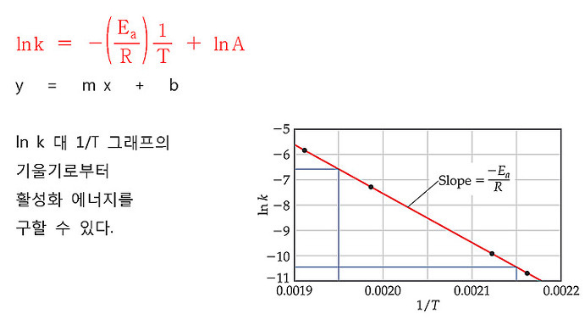
활성화에너지를 구하는 것과 마찬가지로 이온전도체 시스템에서 이온전도도와 온도에 따른 그래프를 그리고 이로부터 이온이 이동하는데 필요한 활성화 에너지를 구할 수 있음.
반응형
'Study > General' 카테고리의 다른 글
| [전기화학/일반화학] 산화, 환원 (1) | 2024.08.25 |
|---|